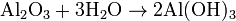ACIDOS, BASES Y SALES
Hemos escuchado miles de veces como se creo la vida en la tierra, y muchas de esas teorias contienen información demostrada a base de compuestos quimicos, de los cuales las sales hacen parte primordial. Escuchamos como la tierra era un caldo primitivo, con lo cual nos referimos, a que la tierra contenia sales, que para su creación se combinaron acidos y bases, de los cuales hoy gozamos en el laboratorio; pero ¿Que tanto sabemos de estos compuestos? Puesto que la quimica esta llena de formulas, muy pocas veces nos preguntamos por lo que hay dentro de estas, ya que siempre queremos analizar el resultado. Hoy, en este blog dare a conocer todo lo que nos hace falta saber sobre ciertos compuestos que usualmente denominamos acidos, sales, y bases. En este blog tambien se encontraran evidencias de ejercicios quimicos realizados con la herramienta Yenka, por la cual se sacaran conclusiones.
OBJETIVOS:
- Generar una mejor alternativa de aprendizaje para nuestro enriquecimiento
- Lograr clarificar los terminos que comunmente utilizamos en el area
- Propiciar el buen uso de las tics en los tiempos libres
- Aplicar lo aprendido, en la creación de nuevos experimentos
- Reconocer las distintas propiedades de los elementos nombrados
JUSTIFICACIÓN:
Los compuestos como los acidos, las sales y las bases, son escenciales en las formación de ecuaciones quimicas, soluciones, entre otras aplicaciones que usualmente les damos a estos, por lo tanto, el conocimiento de estas, nos hara capaces de darles la logica a la hora de usarlos, y tener en cuenta ciertas precauciones a la hora que hagamos practicas en el laboratorio.
¡¡EMPECEMOS!!
BASES
Es cualquier sustancia que presente propiedades alcalinas. En primera aproximación (según Arrhenius) es cualquier sustancia que en disolución acuosa aporta iones OH− al medio.
Los conceptos de base y ácido son contrapuestos. Para medir la basicidad de un medio acuoso se utiliza el concepto de pOH, que se complementa con el de pH, de forma tal que pH + pOH = 14. Por este motivo, está generalizado el uso de pH tanto para ácidos como para bases.
Según la teoría de Lewis una base es aquella sustancia que puede donar un par de electrones. El ion OH−, al igual que otros iones o moléculas como el NH3, H2O, etc., tienen un par de electrones no enlazantes, por lo que son bases. Todas las bases según la teoría de Arrhenius o la de Brønsted y Lowry son a su vez bases de Lewis.
- Ejemplos de bases de Arrhenius: NaOH, KOH, Al(OH)3.
- Ejemplos de bases de Brønsted y Lowry: NH3, S2−, HS−.
Una base fuerte es la que se disocia completamente en el agua, es decir, aporta el máximo número de iones OH−. El hidróxido potásico es un ejemplo de una base fuerte.
Una base débil también aporta iones OH− al medio, pero está en equilibrio el número de moléculas disociadas con las que no lo están.
PROPIEDADES DE LAS BASES:
Finalmente, según Boyle, bases son aquellas sustancias que presentan las siguientes propiedades
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica.
- Cambian el papel tornasol rojo en azul.
- La mayoría son irritantes para la piel (cáusticos) ya que disuelven la grasa cutánea.
- Son destructivos en distintos grados para los tejidos humanos.
- Los polvos, nieblas y vapores provocan irritación respiratoria, de piel, ojos, y lesiones del tabique de la nariz.
- Tienen un tacto jabonoso.
- Son solubles en agua (sobre todo los hidróxidos).
- Reaccionan con ácidos formando sal y agua.
FORMACIÓN:
Al reaccionar un metal activo con agua, se libera una base y se libera el gas hidrogeno, un ejemplo es la formación de hidroxido de litio
Tambien al reaccionar un oxido basico con el agua
Ej:
NOMENCLATURA:
La nomenclatura viene a ser un conjunto de normas que indican el nombre que deben llevar las formulas de las moleculas y permiten su identificación.
Una base se crea a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga -1.
EJEMPLOS DE BASES:
- Soda cáustica (NaOH)
- Leche de magnesia (Mg(OH)2)
- El cloro de piscina (hipoclorito de sodio)
- Antiácidos en general
- Productos de limpieza
- Amoníaco (NH3)
- Jabón y detergente
- Bicarbonato de sodio
ACIDOS
Un acido es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.
A las sustancias químicas que tienen la propiedad de un ácido se les denomina ácidas.